【實體+線上同步課程】醫療器材法規、驗證與確效技術人員實務系列
《 課程介紹 》
《 課程介紹 》
單元一:QMS 與 ISO 13485 醫療器材品質管理系統 是目前國內與國際醫材產業對於製造業者所依據的重要標準,其要求在醫材生命週期的一個或多個階段的組織所採用,從產品開發到上市與上市後之醫材全生命週期的解析與說明。
單元二:進入產品開發最重要的評估過程,醫材風險管理與可用性評估 ,此單元提供醫材製造業者,於產品設計之初,藉了解預期使用者,進行風險分析,導入設計考量,並加以驗證,充分掌握產品,開發出安全、有效、容易操作的醫療器材,增加產品安全性及使用滿意度,以及減少培訓和用戶服務需求或投訴,並於醫材研發前期及全生命週期即能導入風險管理標準之流程。
單元三:MDR的符合是為進入歐盟市場的必須要求 ,為確保醫療器材在生命週期裡的安全及功效,並更有系統性地管理欲在歐盟市場銷售後之醫療器材。本課程詳細介紹歐盟醫療器材法規條文要求與技術文件要求,讓學員可充分瞭解新版MDR的重點及如何準備,並透過實際演練提升學員學習成效。
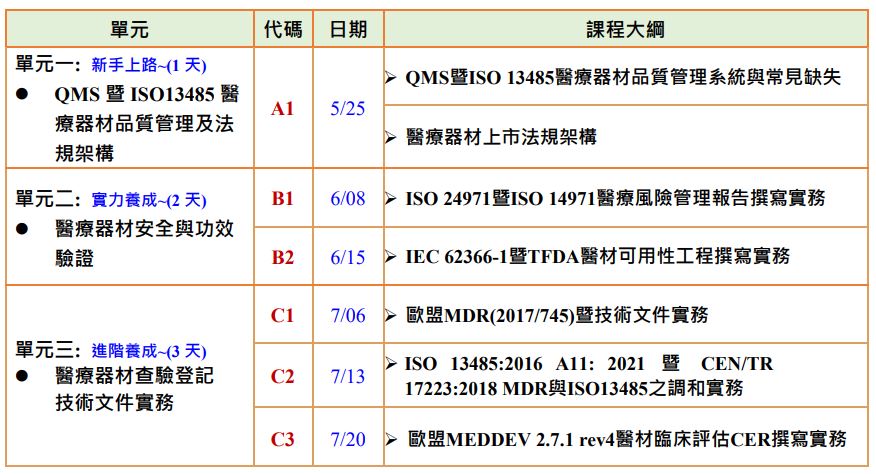
單元二:進入產品開發最重要的評估過程,醫材風險管理與可用性評估 ,此單元提供醫材製造業者,於產品設計之初,藉了解預期使用者,進行風險分析,導入設計考量,並加以驗證,充分掌握產品,開發出安全、有效、容易操作的醫療器材,增加產品安全性及使用滿意度,以及減少培訓和用戶服務需求或投訴,並於醫材研發前期及全生命週期即能導入風險管理標準之流程。
單元三:MDR的符合是為進入歐盟市場的必須要求 ,為確保醫療器材在生命週期裡的安全及功效,並更有系統性地管理欲在歐盟市場銷售後之醫療器材。本課程詳細介紹歐盟醫療器材法規條文要求與技術文件要求,讓學員可充分瞭解新版MDR的重點及如何準備,並透過實際演練提升學員學習成效。

*工研院產業學院為衛福部核可辦理醫材人員訓練及認證之合格單位,本課程完訓後可申請時數認證,惟實際申請仍以衛福部查核結果為準,敬請學員踴躍報名。
*本課程符合勞委會 "協助事業單位人力資源提升計畫" 的補助方案,歡迎企業踴躍報名參加。
《 課程資訊 》
課程日期:2023年5月25日~ 2023年7月20日
課程型態:工研院產業學院 台中學習中心-訓練教室 或 WEBEX線上直播
聯絡資訊:陳小姐(04-25672316)
課程連結:https://college.itri.org.tw/Home/LessonData/DB66F4AA-8485-423D-819A-EFFD3239FE61
《 講師介紹 》

*本課程符合勞委會 "協助事業單位人力資源提升計畫" 的補助方案,歡迎企業踴躍報名參加。
《 課程資訊 》
課程日期:2023年5月25日~ 2023年7月20日
課程型態:工研院產業學院 台中學習中心-訓練教室 或 WEBEX線上直播
聯絡資訊:陳小姐(04-25672316)
課程連結:https://college.itri.org.tw/Home/LessonData/DB66F4AA-8485-423D-819A-EFFD3239FE61
《 講師介紹 》



