醫材CRO顧問輔導
醫療器材臨床試驗是指透過收集臨床前動物試驗報告、臨床試驗結果、相似產品之臨床文獻,臨床使用經驗和上市後臨床追蹤,作為臨床資料依據,基於依據資料,預期醫療器材在按照正常使用條件下,其利益、風險與適應症,並依據臨床知識、技術及文獻,證明該利益/風險是可接受的。因此醫材臨床試驗計畫書規劃輔導及執行、GCP訓練及模擬查核,臨床試驗報告等任務,都需要有實務經驗豐沛的CRO來協助,領証(CRO)顧問團隊單是醫材臨床試驗計畫審查及執行經驗已超過18年,是您可以信賴的臨床試驗顧問夥伴。
TFDA醫療器材優良臨床試驗管理辦法
1. 執行臨床試驗,應遵行下列規定:
(1) 符合赫爾辛基宣言之倫理原則。
(2) 符合科學原則。
(3) 符合風險最小化原則,對受試者侵害最小,並 確保風險與利益相平衡。
(4) 經臨床試驗倫理審查委員會核准。
(5) 徵求受試者同意。
(6) 保障受試者之自主權及隱私權。
2. 試驗委託者應擬訂臨床試驗計畫,經審查會及中央 主管機關核准後,始得執行。試驗主持人及臨床試驗機構應依前項核准之計畫,執行臨床試驗。
TFDA體外診斷醫療器材臨床性能研究指引
1. 本指引就體外診斷醫療器材臨床性能研究之規劃、設計、執行、記錄與通報訂定相關作業規範,旨在保護受試者之權利、安全及福祉,並確保臨床性能研究之執行符合倫理與科學,且研究結果正確可信。
2. 為保護受試者之權利、安全及福祉,並確保體外診斷醫療器材臨床性能研究之執行符合倫理與科學,且研究結果正確可信。因此參考 ISO 國際標準組織TC 212,於2019年5月發布國際標準ISO 20916:2019,訂定「體外診斷醫療器材臨床性能研究指引」,並作為第二等級及第三等級體外診斷醫療器材查驗登記審查之臨床評估報告補充說明。
2. 為保護受試者之權利、安全及福祉,並確保體外診斷醫療器材臨床性能研究之執行符合倫理與科學,且研究結果正確可信。因此參考 ISO 國際標準組織TC 212,於2019年5月發布國際標準ISO 20916:2019,訂定「體外診斷醫療器材臨床性能研究指引」,並作為第二等級及第三等級體外診斷醫療器材查驗登記審查之臨床評估報告補充說明。
ISO 14155:2020 醫療器材人體試驗(GCP)
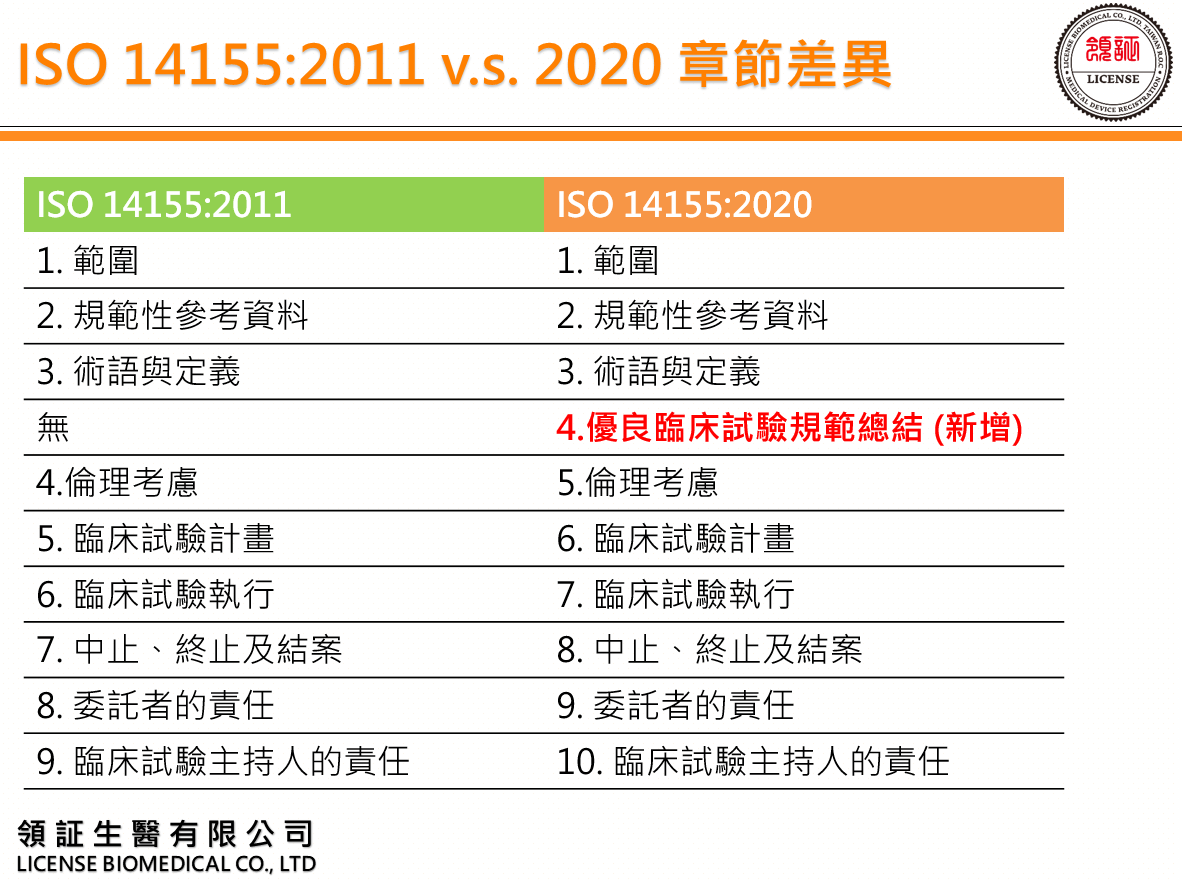
1. ISO 14155:2011 v.s. 2020 章節差異

2. 本標準旨在規定一般要求:
(1)保護受試者的權利、安全、福祉,確保臨床試驗 的科學進行與臨床試驗結果的可信度。
(2)定義委託者和主持人的職責;協助委託者、試驗人員、倫理委員會、監管機構和其他參與醫療器材合格評定的機構。
註1: 使用本文需要考慮其他標準和/或國家要求,是否適用於準備申請的試驗用醫療器材或臨床試驗。
註2: 對於作為醫療器材的軟體(SaMD)證明分析有效性的輸出對於給訂定的輸入是準確的,以及在適當情況下,科學有效性SaMD的輸出與預期臨床狀況、生理狀態相關、及SaMD 的臨床表現。SaMD的輸出結果與目標用途具有臨床意義。本標準的要求在相關範圍內適用(參考文獻4),豁免本標準要求的理由可考慮受試者與SaMD之間的間接接觸獨特性。
註3: 國際標準組織於2019 年5 月發布國際標準ISO 20916:2019,訂定「體外診斷醫療器材臨床性能研究指引」作為國際間執行體外診斷醫療器材臨床性能試驗評估報告的實踐指引參考 (如歐盟的IVDR),強化對於體外診斷醫療器材之管理,確保體外診斷醫療器材之安全及效能。


2. 本標準旨在規定一般要求:
(1)保護受試者的權利、安全、福祉,確保臨床試驗 的科學進行與臨床試驗結果的可信度。
(2)定義委託者和主持人的職責;協助委託者、試驗人員、倫理委員會、監管機構和其他參與醫療器材合格評定的機構。
註1: 使用本文需要考慮其他標準和/或國家要求,是否適用於準備申請的試驗用醫療器材或臨床試驗。
註2: 對於作為醫療器材的軟體(SaMD)證明分析有效性的輸出對於給訂定的輸入是準確的,以及在適當情況下,科學有效性SaMD的輸出與預期臨床狀況、生理狀態相關、及SaMD 的臨床表現。SaMD的輸出結果與目標用途具有臨床意義。本標準的要求在相關範圍內適用(參考文獻4),豁免本標準要求的理由可考慮受試者與SaMD之間的間接接觸獨特性。
註3: 國際標準組織於2019 年5 月發布國際標準ISO 20916:2019,訂定「體外診斷醫療器材臨床性能研究指引」作為國際間執行體外診斷醫療器材臨床性能試驗評估報告的實踐指引參考 (如歐盟的IVDR),強化對於體外診斷醫療器材之管理,確保體外診斷醫療器材之安全及效能。
領証顧問輔導優勢
醫材臨床試驗(評估)為領証(CRO)最大優勢,石紀博士為現任三大醫學中心之人體試驗委員會(IRB)諮詢專家、台灣生技醫療照護輔具協會法規主委兼顧問、醫學中心育成中心委員及高雄市醫材商業公會及中華民國產業發展聯合總會之顧問,具備審查主管機關(TFDA 及CDE)審查醫材臨床試驗計畫及報告之評核經驗。
我們根據您的醫材產品,收集相似產品資料與差異性分析、臨床文獻搜索、上市後不良事件,與臨床試驗資料整合歸納及內部審核,撰寫符合國際法規要求的臨床評估報告送審後,我們具備與各國審查主管機關答辯能力,保證高效益的執行達成率。
我們根據您的醫材產品,收集相似產品資料與差異性分析、臨床文獻搜索、上市後不良事件,與臨床試驗資料整合歸納及內部審核,撰寫符合國際法規要求的臨床評估報告送審後,我們具備與各國審查主管機關答辯能力,保證高效益的執行達成率。


