歐盟臨床評估指引
1. 本指引MEDDEV 2.7.1 Rev 4 依據
(1) 93/42/EC指令附錄I 第6a節(經2007/47/EC號指令修訂)
(2) 90/385/EEC指令附錄1 第5a節(經2007/47/ EC號指令修訂)
要證明醫療器材符合基本要求時,必備依93/ 42/EEC指令附錄X,或90/385/EEC指令附錄7進行臨床評估。
2. A9臨床評估報告範例:





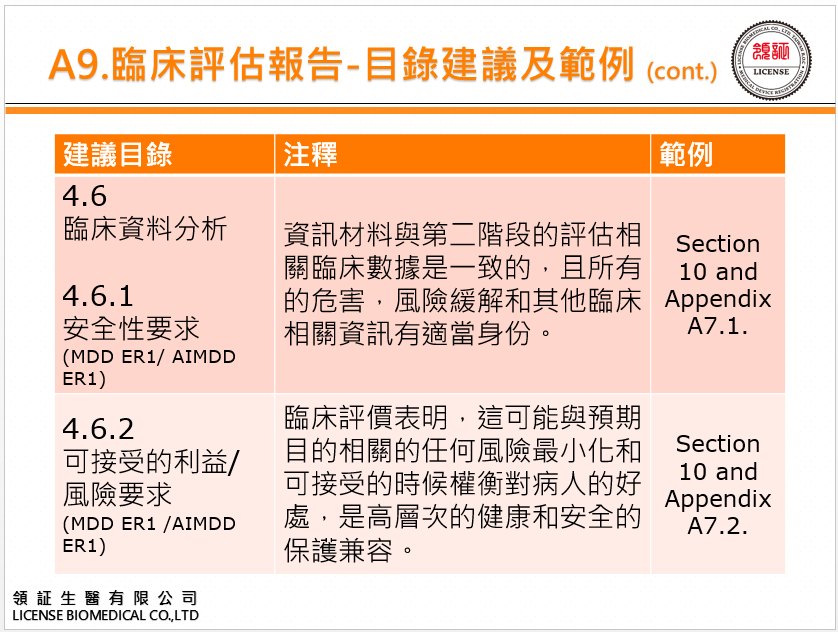



1. 本指引MEDDEV 2.7.1 Rev 4 依據
(1) 93/42/EC指令附錄I 第6a節(經2007/47/EC號指令修訂)
(2) 90/385/EEC指令附錄1 第5a節(經2007/47/ EC號指令修訂)
要證明醫療器材符合基本要求時,必備依93/ 42/EEC指令附錄X,或90/385/EEC指令附錄7進行臨床評估。
2. A9臨床評估報告範例:









領証CRO顧問團隊優勢
我們的CRO顧問合作團隊,遵守國際醫藥法規和ICH準則,為您執行高標準的臨床試驗,確保您的臨床報告,符合臨床計劃與法規要求。
領証CRO提供您以下服務:
- 研究機構(CRO)媒合與臨床試驗規劃
- 人體試驗委員會IRB送審
- 專案管理監控並回報試驗進度
- 衛生主管機關送審
- 臨床評估報告撰寫


